PD-1(programmed cell death protein 1)程序性死亡受体1,是一种重要的免疫抑制分子。PD-1和PD-L1结合启动T细胞的程序性死亡,使肿瘤细胞获得免疫逃逸。目前,以PD-1/PD-L1为靶点的抗体药物可广泛用于癌症的免疫疗法,是一类不依据肿瘤来源进行区分的广谱抗癌药物。上海复宏汉霖生物技术有限公司研发的单克隆抗体HLX10可通过封阻PD-L1配体与PD-1蛋白受体的结合,从而抑制该信号通路的传导,最终达到活化免疫细胞、杀死肿瘤细胞的作用。然而,HLX10如何实现识别PD-1 以及其与功能之间的关系在很大程度上还是未知的。因此,HLX10抗原结合片段(Fab)与PD-1蛋白复合物结构的解析可以为其生理功能的研究提供新的理论支持。
2021年12月31日,国家蛋白质科学研究(北京)设施清华基地、清华大学结构生物学高精尖创新中心——x射线晶体学平台和上海复宏汉霖生物技术有限公司合作在《PLOS ONE》杂志上在线发表了题为“Structural basis of HLX10 PD-1 receptor recognition, a promising anti-PD-1 antibody clinical candidate for cancer immunotherapy” 研究论文,文中描述了一种全新的全人源抗PD-1 IgG 4单抗HLX10在体内有明显疗效。对其体外活性进行了表征,结果表明HLX10具有明显影响t细胞增殖和细胞因子分泌的体外活性。HLX10在几个同基因和异种移植模型生长中,具有抑制肿瘤的作用,并可以与阿瓦斯汀生物类似物协同抑制肿瘤。该论文首次报道了HLX10抗原结合片段(Fab)与PD-1的1.78 Å高分辨率的复合物结构,将HLX10与上市药物Nivolumab和Pembrolizumab进行了比较,阐明了三种抗体相似的作用抑制机制以及三者免疫表位的差异。
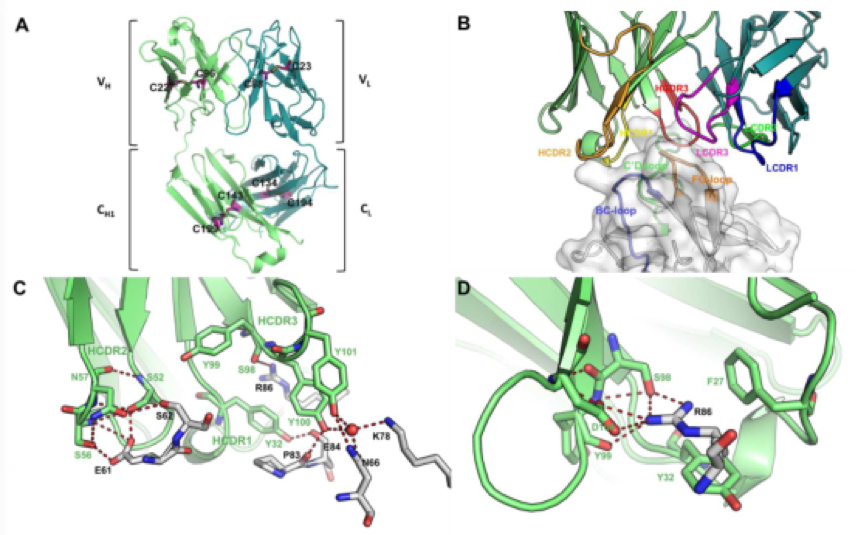
图1 Interaction between HLX10 and hPD-1
文中该复合物结构中的HLX10 Fab采用了典型的β-三明治免疫球蛋白折叠结构,分子内有四对二硫键(LC:Cys23-Cys88,Cys134-Cys194;HC: Cys22-Cys96, Cys143-Cys199)(图1A)。HLX10 Fab的VH和VL的6个CDR均与PD-1相互作用,LCDR1与hPD-1接触最少(图1B)。结合界面是由PD-1的三个环区如CD环、BC环和FG环组成。hPD-1位于CD环中的Arg86是相互作用的关键部分,它与Asp104形成两个盐桥,与Ser98形成两个氢键,与HCDR3的Tyr99形成一个氢键,同时也与HCDR1的Tyr32形成π-π相互作用(图1C和D)。
为了探讨HLX10阻断PDL-1的机制,文中比较了hPD-1/HLX10-fab与hPD-1/hPD-L1 (PDB: 4ZQK)和hPD-1/ hPD-L2 (PDB: 6UMT)的复合物的晶体结构。据报道PD-1与PD-L1之间存在分子间相互作用主要通过CC’FG片(折叠)发生,并诱导PD-1 CC’环发生轻微地构象变化,使它能够结合在PD-L1分子周围。值得注意的是, hPD-1/HLX10- fab结构表明,PD-1被HLX10识别的位点与PD-1中负责与PD-L1和PDL-2相互作用的残基高度重叠。Asn66、Lys78、Ile126、Lys131、Ala132和Ile134除参与氢键以外,还与HLX10 Fab和PDL-1都生成疏水相互作用。由于HLX10 Fab与PD-1的相互作用严重依赖于PD-1的柔性CD环,而不是直接依赖参与PD-L1互作的位点,这确保HLX10可以与PD-L1竞争结合。
进一步阐明HLX10-Fab抑制机制,文中把PD-1-HLX10-Fab与 PD-1-nivolumab-fab (PDB:5WT9)和PD-1- Pembrolizumab- (PDB:5GGS) 的复合物结构做了对比,HLX10与Nivolumab和Pembrolizumab的免疫表位具有相似的结构和取向。值得注意的是,与Pembrolizumab相比,HLX10显示了相反的重链(HC)和轻链(LC)使用。HLX10和Pembrolizumab 与hPD-1的相互结合都严重依赖于PD-1的 CD柔性环,HLX10的免疫表位与Pembrolizumab的重叠多于与Nivolumab的重叠。这些结构分析表明HLX10、nivolumab和Pembrolizumab具有相似作用机制——它们通过直接占用PDL1的结合位点和空间位阻,竞争性抑制其结合。
该研究详细讲述了HLX10在体外和体内具有相似或更好的生物活性的活性,阐明了HLX10阻断PDL-1的机制,为后续癌症的临床评价提供了理论基础。
清华大学生命科学学院、清华大学结构生物学高精尖创新中心、国家蛋白质科学研究(北京)设施清华基地X射线晶体学平台范仕龙及复宏汉霖公司Hassan Issafras为论文共同通讯作者。本工作获得清华大学结构生物学高精尖创新中心、北京生物结构前沿研究中心、国家蛋白质科学研究(北京)设施清华基地的大力支持。
参考文献:
Citation:IssafrasH,FanS,TsengC-L,ChengY,LinP,XiaoL,etal.(2021)Structural basis of HLX10 PD-1 receptor recognition, a promising anti-PD-1 antibody clinical candidate for cancer immunotherapy. PLoS ONE16(12):e0257972.
原文链接:





