作者:陈宇凌
前段时间,Cell Stem Cell发表了一篇题目为“Single-Cell Proteomics Reveal that Quantitative Changes in Co-expressed Lineage-Specific Transcription Factors Determine Cell Fate”的文章,引起了大家的广泛关注,不少朋友问我:“质谱可以做单细胞的蛋白质组学吗?” 当然可以!只是使用常规蛋白质组学目前在单细胞中最多只能检测到800个左右的蛋白,并不能提供单细胞中重要蛋白的相关信息。而这篇文章用的是质谱流式细胞技术,主要用于定量检测单细胞表面的蛋白标志物。今天,我们就来介绍一下质谱流式细胞技术。
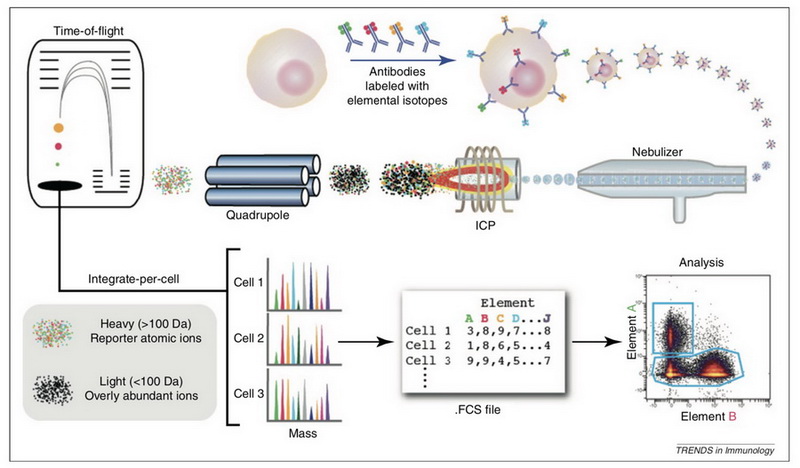
图1. 质谱流式细胞技术经典流程1
从技术流程来看,耦连镧系金属的亲和试剂(一般是抗体)和细胞中的底物结合后, 以单细胞液滴形式雾化后进入电感耦合等离子体质谱(Inductively coupled plasma mass spectrometry,ICP-MS),在质谱中被高能量氩气分子离子化,四级杆选择只通过镧系金属质量范围内的离子并去除其他多余离子,利用飞行时间质谱检测器中检测镧系金属离子的信号强度,以此表征单个细胞内对应底物的表达量。
目前,质谱流式细胞技术可以同时对51个靶蛋白进行检测,每秒检测1000个细胞,平均每天可检测100个样品,最低检测限为100个拷贝分子,已经过验证的镧系金属标记抗体种类超过400种;除常规蛋白外,质谱流式细胞技术还可用于蛋白翻译后修饰1,蛋白降解产物5,检测细胞存活率,细胞大小,mRNA转录子表达量6,DNA合成速率7以及蛋白酶活性8等的测定。
多路质谱流式细胞技术
正如蛋白质组学中的非标记定量,质谱流式细胞技术对靶点的定量准确性也受到不同仪器离子化效率的差异、仪器状态等的影响;同时,传统的质谱流式细胞技术每次只能检测一个样品,通量较低。因此,质量标签细胞条码技术(mass-tag cellular barcoding,MCB)应运而生。
细胞经过药物等处理后,用多聚甲醛固定后,使用MCB试剂对不同样本的细胞进行条形码标记,然后将不同样本混合后进行常规质谱流式细胞分析前处理和检测。最终通过检测条形码对应的元素离子,对细胞进行样品归类。

图2. 多路质谱流式细胞技术9
多路质谱流式细胞技术实验步骤如图2所示,不同处理的样本经过甲醛固定,使用不同mDOTA分子对不同样本进行标记,然后进行常规的质谱流式细胞分析的前处理和检测。
这里使用的mDOTA分子是一个双功能化合物,一端可以螯合金属离子,一端则可以和细胞中蛋白上的自由巯基以共价键形式结合(如图3所示),一个mDOTA分子可以螯合一个镧系金属元素原子,那为什么叫barcode呢?Barcode 就是指可以同时添加多种被镧系金属元素螯合的mDOTA分子,在CyTOF中共价键被打碎后,每种镧系金属元素的峰即可形成有和无两种情况,使用的镧系金属元素螯合的mDOTA试剂的种类越多,最终可组成的条形码种类越多,如图4所示,使用7种镧系金属元素螯合mDOTA试剂,可以组成2的7次方种条形码,即可以同时标记128个样品。MCB的使用,可以对多个样本同时进行单细胞定量分析,增加了质谱流式细胞分析技术的分析通量,并且增加了相对定量的准确性。本文一开始提到的那篇Cell Stem Cell的文章,就是利用MCB技术,在单细胞层面研究人源红细胞生成过程中内源转录因子的表达和调控。
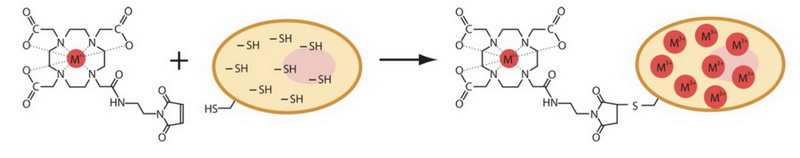
图3. mDOTA分子反应原理10
细胞使用双功能分子mDOTA(maleimido-mono-amide- DOTA)以共价键形式进行标记。mDOTA一端可以螯合稀土元素,一端可以和细胞内的蛋白的巯基反应。
但是MCB存在一定的缺陷,首先在每次仪器校正后,质谱流式细胞仪的离子检测灵敏度都会发生变化,尽管可以用内参进行校正,将样品混合后检测会降低样品之间的变化程度;其次,MCB使用镧系金属元素和后期使用的抗体耦连的镧系金属不能相同,因此MCB的使用缩小了后续标记抗体的选择范围。因此,后来基于钯元素的MCB试剂被进一步发展出来11。使用钯元素的6个同位素原子进行MCB分子的构建有以下两点优势:首先,钯元素因为和标记抗体的试剂(Diethylene triamine pentaacetic acid (DTPA)-based polymer)不兼容,抗体标记不会使用钯元素,因此MCB分子使用钯元素不会干扰后续标记抗体的选择;第二,Pd有6个稳定同位素,102, 104, 105, 106, 108和110 amu, 纯度很高,分别为91%, 96%, 98%, 99%, 99%和99%,这些同位素和其他镧系金属元素质量相差甚远,不会影响后续的抗体耦连的镧系金属元素的检测。
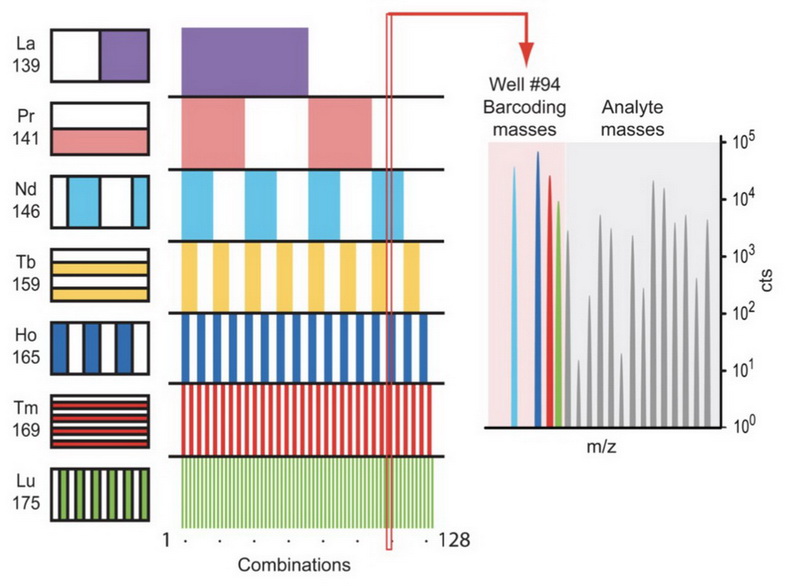
图4. MCB形成原理
使用七种镧系金属元素螯合mDOTA试剂,按图中分布添加mDOTA试剂,可以组成2的7次方种条形码,即可以同时标记128个样品。
质谱流式细胞技术的优缺点
最后我们简单说一下这个技术的优缺点。优点是可同时检测的通道比较多,现在可以做到同时检测51个目标蛋白;可操作性强,试剂都是商品化的;速度虽然比不上流式细胞仪(每秒10000个细胞),但也并不慢,每秒可检测1000个细胞;成本低,平均每个细胞测量成本仅需0.005美分,对比单细胞测序技术每个细胞平均22美元,可以说是相当便宜了。
当然,就目前来看,这个技术还存在不少的不足之处。首先,细胞在分析中被雾化并离子化,在分析后不能保留完整的活细胞状态;其次,灵敏度低于荧光基团,不能检测极低水平表达的分子,检测的动态范围最多只能达到3-4倍,而荧光基团的检测范围则可到50倍左右;第三,不同仪器之间的离子化效率不同,需要通过掺入聚苯乙烯珠子进行信号强度的校正,实现同一个仪器的数据的比较;第四,和基于荧光基团的流式细胞技术一样,质谱流式细胞技术仍然不能检测小分子代谢产物,并且不能对一个细胞进行连续的动态监测;最后,也是最重要的一点,不能对蛋白组中的所有蛋白进行监测,只能对特定目标蛋白进行检测,因此需要更为严谨的实验设计。
不管怎样,质谱流式细胞技术还在不断地发展和改进,我们能利用这个技术解决的问题也越来越多。希望通过这次对质谱流式细胞技术的系统性介绍,也能为大家目前面临的问题提供一点新思路,为大家的课题添砖加瓦。
参考文献:
1. Bendall, S. C.; Nolan, G. P.; Roederer, M.; Chattopadhyay, P. K., A deep profiler's guide to cytometry. Trends Immunol 2012, 33 (7), 323-32.
2. Thomas, R., Practical Guide to ICP-MS: A Tutorial for Beginners, Second Edition. Pract Spectrosc 2008, 1-339.
3. Lou, X. D.; Zhang, G. H.; Herrera, I.; Kinach, R.; Ornatsky, O.; Baranov, V.; Nitz, M.; Winnik, M. A., Polymer-based elemental tags for sensitive Bioassays. Angew Chem Int Edit 2007, 46 (32), 6111-6114.
4. Majonis, D.; Herrera, I.; Ornatsky, O.; Schulze, M.; Lou, X. D.; Soleimani, M.; Nitz, M.; Winnik, M. A., Synthesis of a Functional Metal-Chelating Polymer and Steps toward Quantitative Mass Cytometry Bioassays. Anal Chem 2010, 82 (21), 8961-8969.
5. Bjornson, Z. B.; Nolan, G. P.; Fantl, W. J., Single-cell mass cytometry for analysis of immune system functional states. Curr Opin Immunol 2013, 25 (4), 484-494.
6. Frei, A. P.; Bava, F. A.; Zunder, E. R.; Hsieh, E. W. Y.; Chen, S. Y.; Nolan, G. P.; Gherardini, P. F., Highly multiplexed simultaneous detection of RNAs and proteins in single cells. Nat Methods 2016, 13 (3), 269-+.
7. Behbehani, G. K.; Bendall, S. C.; Clutter, M. R.; Fantl, W. J.; Nolan, G. P., Single-cell mass cytometry adapted to measurements of the cell cycle. Cytom Part A 2012, 81a (7), 552-566.
8. Edgar, L. J.; Vellanki, R. N.; Halupa, A.; Hedley, D.; Wouters, B. G.; Nitz, M., Identification of Hypoxic Cells Using an Organotellurium Tag Compatible with Mass Cytometry. Angew Chem Int Edit 2014, 53 (43), 11473-11477.
9. Spitzer, M. H.; Nolan, G. P., Mass Cytometry: Single Cells, Many Features. Cell 2016, 165 (4), 780-791.
10. Bodenmiller, B.; Zunder, E. R.; Finck, R.; Chen, T. J.; Savig, E. S.; Bruggner, R. V.; Simonds, E. F.; Bendall, S. C.; Sachs, K.; Krutzik, P. O.; Nolan, G. P., Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat Biotechnol 2012, 30 (9), 858-U89.
11. Zunder, E. R.; Finck, R.; Behbehani, G. K.; Amir, E. D.; Krishnaswamy, S.; Gonzalez, V. D.; Lorang, C. G.; Bjornson, Z.; Spitzer, M. H.; Bodenmiller, B.; Fantl, W. J.; Pe'er, D.; Nolan, G. P., Palladium-based mass tag cell barcoding with a doublet-filtering scheme and single-cell deconvolution algorithm. Nat Protoc 2015, 10 (2), 316-333.
本文章版权归清华大学蛋白质研究技术中心蛋白质化学与组学平台所有
本篇为最后一篇





