作者:常卿
BLI,Bio-Layer Interferometry,生物膜干涉技术,是基于干涉光谱图的位移变化来检测生物分子间相互作用的一种实验方法。将生物分子结合到传感器(Biosensor)表面形成了一层生物膜,当一束可见光从光谱仪射出后,在传感器末端的光学膜层的两个界面会形成两束反射光谱,并形成一束干涉光谱。任何由于分子结合而形成的膜层厚度及密度变化,能够通过干涉光谱的位移值而体现,从而可以检测结合到传感器表面分子数量的变化。
通过BLI技术可提供实时的、非标记的分子相互作用及含量检测信息。特别是可实时监控整个结合过程,并计算出分子之间的亲和力(KD)、结合速率(kon)、解离速率(koff)等重要数据。被广泛应用于生物分子相互作用的研究中。
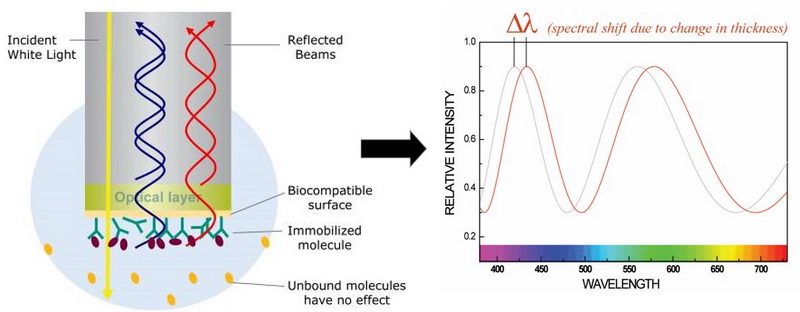
Fig. 1 生物膜干涉的原理
在进行BLI实验过程中,很多同学都会遇到非特异性结合(Non-Specific Binding,NSB)的问题。今天我们来讲讲非特异性结合(NSB)。
非特异性结合存在于所有的表面化学/技术中,存在于所有的固液界面。基于固液反应的检测方法有很多,比如亲和层析、免疫标记技术(ELISA)、微阵列芯片技术、表面等离子共振SPR、生物膜干涉BLI等,这些方法都不可避免NSB的问题。
什么是非特异性结合?
非特异性结合有不同的种类。一类是指溶液中的分析物结合到空白传感器上;另一类是分析物缓冲液中的组分结合到传感器上的固化物,但是这种结合是我们不期望的。
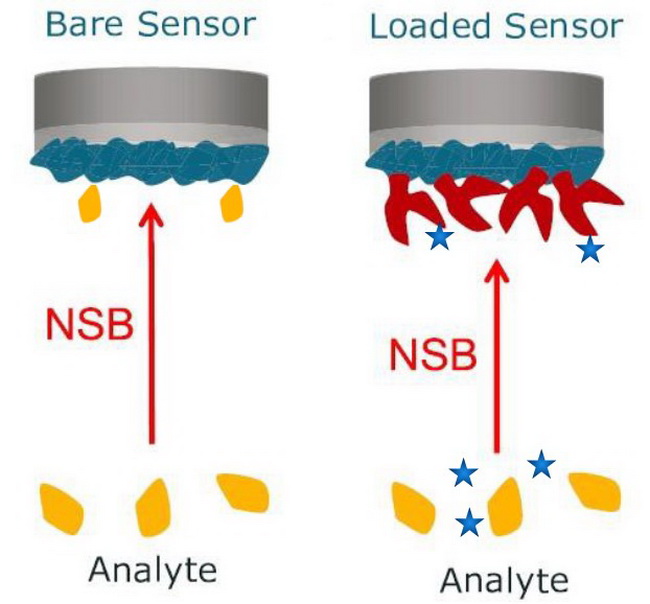
Fig. 2 不同种类的非特异性结合。左图:分析物直接与固相介质(传感器)结合;右图:分析物缓冲液中的其他物质(杂质)与固化物的结合
非特异性作用使如何产生的?
1)库伦作用(coulombic interaction),即静电作用。取决于固体表面或分子所带的电荷,分析物的等电点,和溶液的离子强度。比如传感器表面的海藻酸和葡聚糖在一定的pH下会带有大量电荷,如果分析物带有相反电荷,就容易形成基于库仑力的静电作用。
2)非共价结合,包括范德华作用和疏水作用。如果杂质或者分析物为蛋白质或者带有疏水基团的化合物,而基质也是蛋白质(比如链霉亲和素传感器),就可能形成基于疏水作用的非特异性吸附。
3)分析物与固化物之间的生物相似性:在基于capture的固化反应中,分析物带有同固化蛋白一样的标签。比如用带有his抗体的基质固化his标签的蛋白,但是分析物中有同样的标签,就很难避免his标签的分析物直接与固相反应。
4)杂质的作用:在诸如血液,细胞裂解液等粗样品中,杂质产生的非特异性作用很普遍。
无论NSB的理论原因如何,用户必须通过适当的对照实验进行分析,以排除故障并找到最佳解决方案。
如何鉴别非特异吸附?
首先,确保在每个实验中使用适当的对照。设置传感器的阴性对照,有两种策略:
(1)使用空白缓冲液作为固化物;
(2)使用已知的无关蛋白或突变体作为固化物。
其次,检查结合解离曲线的形状。如Fig.3蓝线所示,这种Heterogeneous Binding通常使由于NSB影响特异性结合而引起的。
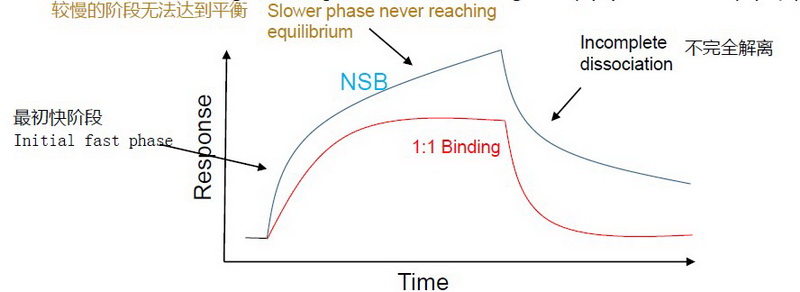
Fig. 3 由于非特异性结合NSB引起的结合曲线的异常
再次,一定要在正式做结合实验前进行条件摸索。包括测试固化物的最佳浓度(以避免异质性),测试分析物对传感器的NSB, 估计动力学试验所需的结合/解离时间。如Fig. 4所示,测试固化物的最佳浓度,总的原则使固化尽可能少的配体,但仍能保障结合足够的分析物用于动力学分析。
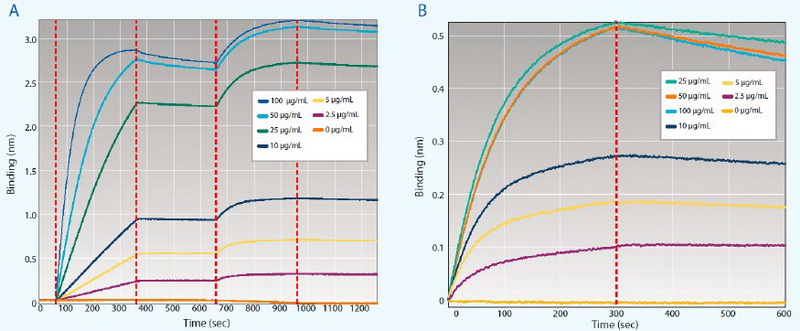
Fig. 4 测试固化物的最佳浓度
如何减轻或者避免非特异性吸附?
首先,了解您正在研究的分子类型。如果非特异性结合主要是静电作用,那么增加盐浓度通常会消除这种NSB。但如果研究的是核酸类样品,它的特异性结合也是通过静电作用,那么在这种情况下想通过提高盐浓度来降低非特异性就需要非常谨慎,以免使特异性信号也降低了。
在使用SA/SSA传感器时,考虑到链霉亲和素的pI值为5,因此在中性和碱性pH下可能吸引带负电荷的蛋白质引起NSB。
对于小分子化合物由于使用的浓度较高,往往具有较高的NSB发生率。特别是低亲和力的小分子配体,由于需要在较高浓度下进行测定,除了考虑NSB的影响外,溶解度是一个更大的问题。可以通过增加缓冲液中的DMSO,以更好地溶解小分子化合物。传感器可最高耐受10%DMSO。此外还可以加入甘油、PEG或类似的亲水剂,或选择合适的表面活性剂浓度。
改善或消除非特异性结合的方法有以下几种,可以根据具体情况进行尝试。
(1)摸索分析物和配体的最佳浓度。如Fig. 4所示。
(2)优化反应缓冲液,包括摸索合适的pH条件;提高盐离子浓度,如NaCl最高至500 mM(需考虑样品的特定生理特性);增加表面活性剂浓度,非离子型如Tween-20,最高至0.05%。如Fig.5所示。
(3)增加封闭步骤,在反应缓冲液中加入BSA ,浓度 1-2%;如果BSA有干扰,可以用酪蛋白,PEG,明胶或脱脂奶粉替代,或采用其他商品化的封闭缓冲液。如Fig.5所示,图A和B是不加封闭步骤,可以看到有非常强的NSB信号,导致结合信号基本都被掩盖了。图E和F是对反应缓冲液进行了优化,添加了0.1% BSA和0.05% Tween 20,并且在结合反应前,增加了300s的封闭步骤,很好的消除了NBS的影响,获得了可用的数据。
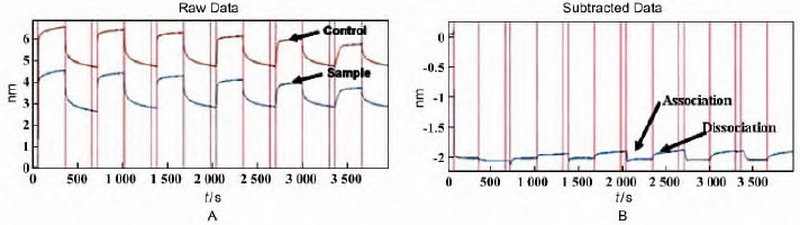
Fig.5 优化反应缓冲液和增加封闭步骤以消除NSB影响(图引自Chinese Journal of New Drugs 2016,25(16):1861-7)
(4)固化物和分析物对换。即固定之前的分析物,分析之前的固化物。
(5)尽可能去除分析物中的杂质。可以对样品进行高速离心处理,尽可能提高分析物的纯度和缓冲试剂的质量。
(6)在分析处理数据时,通过设计对照组,进行非特异信号的扣除。有一个重要前提是NSB信号不应超过总结合信号的10-25%(用户自己定义标准)
(7)更换其他种类的生物传感器测定。比如由NTA传感器换为SA传感器。
(8)当使用SA/SAX/SSA生物传感器时的NSB,可以在生物素化的捕获分子固化到传感器上后,用biocytin 封闭残留的链霉亲和素位点。
(9)当使用血清样品时的NSB,可以在血清样品结合之前使用相同浓度的阴性血清作为基线。
因为生物样品的多样性,非特异性结合是难免会出现的。但只要搞清楚非特异性的种类,再针对性的进行合理优化,还是可以减轻或避免非特异性结合的。
本文章版权归清华大学蛋白质研究技术中心蛋白质制备与鉴定平台所有





