作者:芦亚菲
导读
蛋白表达是指利用细菌、酵母、昆虫细胞、哺乳动物细胞或者植物细胞表达外源基因蛋白的一种分子生物学技术,是基因工程技术中的重要组成部分之一。毕赤酵母表达系统由于其低成本高产出并具有一定翻译后修饰等优点而被越来越多的使用。
一、毕赤酵母表达系统特征
酵母表达系统包括酿酒酵母表达系统,甲醇酵母表达系统以及其他酵母表达系统。毕赤酵母属于甲醇营养型酵母,能够将甲醇作为唯一碳源[1]。那么毕赤酵母表达系统有哪些优势呢,我们总结了以下主要几点:
(1)拥有目前最强,调控机理最严格的启动子之一醇氧化酶基因AOX1启动子,非常利于外源基因的表达调控[1];
(2)具有翻译后的蛋白加工修饰功能例如磷酸化、糖基化等,是一种不可多得的集聚多种优势的真核表达系统;
(3)既可以在细胞内表达,也可在细胞外表达[1];
(4)培养基成本低廉,培养条件简单,生长繁殖速度迅速;
(5)外源基因可以单拷贝或者多拷贝的形式在特定的位点整合进酵母染色体上,伴随着染色体的复制而复制,有较高的遗传稳定性,同酿酒酵母一样以稳定的表达菌株存在[2];
(6)可以进行大规模发酵,适合高密度培养,非常适合重组真核蛋白的工业放大化生产制备。
二、毕赤酵母表达系统常用菌株类型
毕赤酵母宿主菌常用的菌株类型有四种(如表1),分别是X33、GS115、KM71H、SMD116[3]。其中X33是野生型菌株,而GS115和KM71H两种,都具有HIS4营养缺陷标记。GS115 菌株具有AOX1基因,属于Mut+,指的是甲醇利用正常型;KM71 H菌株的AOX1位点被ARG4基因插入,属于Muts,指甲醇利用缓慢型,两种菌株都适用于一般的酵母转化方法[2]。 SMD116(his4 pep4)属于蛋白酶缺失型菌株,它能够表达一些由于蛋白降解而引起的的表达产物分布不均的问题。只是由于SMD116(his4 pep4)菌株生长缓慢,导致表达的外源蛋白质产量低。
表1毕赤酵母宿主菌常用的四种菌株[3]
|
Strain |
Genotype |
Phenotype(Pichia only) |
|
X33 |
wild type |
Mut+ |
|
GS115 |
his4 |
His-, Mut+ |
|
KM71H |
arg4 aox1::ARG4 |
Muts , Arg+ |
|
SMD116 |
his4 pep4 |
Mut+ |
三、毕赤酵母表达载体类型及特征
毕赤酵母表达载体以整合型载体为主,常见的整合型载体包括胞内蛋白表达和分泌蛋白表达两种类型。如果外源蛋白属于细胞溶质型的无糖基化蛋白,则适用于胞内表达。如果外源蛋白能够正常分泌,或者是糖基化蛋白又或者能够分泌到细胞内的细胞器中,那么可以使用分泌表达的方式[1]。
毕赤酵母分泌表达载体主要有:pPICZαA(载体图谱如图1)、pPIC9K等。使用酿酒酵母的分泌信号—α交配因子(α-factor)引导序列已经成功地引导了几种外源蛋白的正确分泌[1]。毕赤酵母胞内表达载体主要有:pPIC3K、pPICZA、pPIC3.5K等。目前平台提供pPICZA载体用于毕赤酵母胞内蛋白表达,pPICZαA用于分泌蛋白的表达,所有载体均利用AOX1启动子来诱导表达。

图1: pPICZα A, B, C载体图谱[3]
毕赤酵母表达载体包含醇氧化酶-1(AOX1)基因的启动子和转录终止子,它们被多克隆位点(MCS)分开,外源基因可以在此插入,此载体还包含组氨醇脱氢酶基因(HIS4)选择标记及3'AOX1区[4]。 X33和GS115菌株的AOX1区或KM71H菌株的AOX1:: ARG4区同载体pPICZ或pPICZα上的两个AOX1区域AOX1启动子区和AOX1转录终止区(TT)任一区域发生单交叉事件,都会在受体菌AOX1或AOX1::ARG4基因的上游或下游插入一个或多个载体拷贝。转化子在X-33或GS115中的表型为Mut+ ,在KM71H中则为MutS[5]。通过在重组质粒AOX1的5'AOX1区进行线性化,可以根据使用的受体菌方便地产生Mut+或MutS重组转化子。图2显示了重组质粒插入完整的AOX1位点(Mut+)的结果,以及pAOX1基因和Zeocin抗性基因的获得,这也发生在未线性化的载体和自连的载体上,但频率较低。
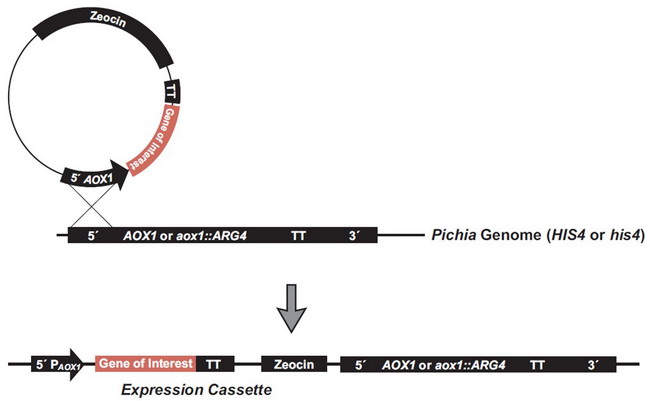
图2 外源基因插入AOX1或aox1::AGR4位点[3]
四、毕赤酵母表达外源蛋白的方法步骤
毕赤酵母表达外源蛋白的基本操作流程如图3所示,具体的操作步骤请看后面的内容。

图3 毕赤酵母表达外源蛋白流程图[3]
1、表达质粒线性化
使用Sac I(209bp)、PmeI(414bp)、BstX I(707bp) [3]三种内切酶中的一种酶(请确保插入的目的基因不含有此酶切位点)对表达质粒进行线性化酶切,这时内切酶会在表达载体pPICZ或者pPICZα的5’AOX1位点处进行酶切。通常酶切切体系为100μL(确保酶切的质粒大于5μg),酶切完后跑电泳检验质粒是否被切开(参考图4a)。
2、酚氯仿抽提质粒
(1)将酶切完后约100μL体系补至400μL;
(2)加入等体积的酚氯仿(酚氯仿取下层),混匀,4度静置10min;
(3)取上层水样,加入500μL预冷无水乙醇,置于—20度,1h,4度离心20min,去上清;
(4)加入250μL70%乙醇,4度,离心20min,去上清;
(5)吹干,加入20μLddH2O。
3、酵母感受态的制备及电转
(1)将酵母菌划线后挑点(参考图4b),5mL YPD(大概能做10支),27℃,220rpm,过夜;
(2)OD600=2.0(1.8-2.0,一般摇12h-18h之间不会长过,500g,4℃离心;
(3)加入2 mLddH2O,500g离心,重复两次;
(4)加入0.5 mL 1M LiCl,0.5 mL 10*TE(100mM Tris 7.5,10mM EDTA),4 mLddH2O,27℃,220rpm,摇1h;
(5)加入125μL DTT(1M),27℃,220rpm,摇30min;
(6)500g离心,去上清,加2 mLddH2O洗2次;
(7)加入1mL1M山梨醇,重悬,冰上静置5min;
(8)取100μL+linear DNA(大于5μg)进行电转,电转杯金属片对两电极,电转杯侧面突起向外,加入DNA后,需在冰上放置5min(电穿孔电击条件:电压:1500V,电阻:400Ω,电容:25μF,脉冲时间:10mS,一次电击);
(9)加入1mL1M山梨醇,洗出至1.5 mLEP管中;
(10) 500g离心,去上清,加入1mLYPD,27℃,220rpm,摇3h;
(11) 500g离心,加入0.1mLYPD,涂zeocin抗性板;
(12) 置于27-30度培养箱培养2-3天后平板上会长出转化子(参考图4c)。

图4 某次实验中质粒线性化及转化结果
4、转化子鉴定及试表达
(1)使用高抗性的板子筛选转化子,待YPD板上长出单菌落,挑取单菌落,在PCR管中涮一下,随后进行PCR菌落筛选验证(参考图5)根据结果,转接入含50mlBMGY的小三角瓶中,30℃,200rpm,培养至OD600=1-1.5;
(2)将小三角瓶中的培养体系转移入100ml离心管,3000g,5min收菌;
(3)沉淀用BMMY重悬至OD600=0.3(约100-200ml);
(4)转移至500ml的大三角瓶中,30℃,200rpm开始诱导表达培养,间隔时间取出1ml速冻后保存于-80℃,并补充终浓度0.5%的甲醇,取样时间点:0h、12h、24h、48h、72h、96h;
(5)各个时间点取的样离心1min取上清,上清取30ul加10ul loading buffer煮10min,离心(13000rpm,5min),取15ul跑SDS-PAGE;
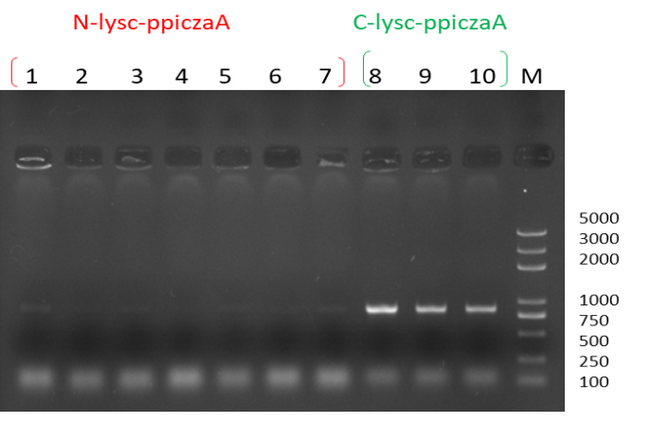
图5 某次实验中PCR screen 结果
5、蛋白提取
(1)将诱导表达一定天数的毕赤酵母离心,如果目的蛋白是分泌表达则收取上清,可以通过我们平台的浓缩包浓缩培养基并将上清置换成裂解缓冲液。如果目的蛋白是胞内表达,则需要将酵母细胞破碎,可以使用我们平台的高压均质机将毕赤酵母细胞破碎(参考图6)。

图6 某次实验中高压破碎结果
(2)可以通过我们平台的亲和层析,离子交换层析以及分子筛层析等层析柱分离纯化目的蛋白,图7为利用毕赤酵母X33菌株表达一种嗜热蛋白酶时通过镍柱亲和层析,热处理,分子筛层析等方法将目的蛋白提纯。
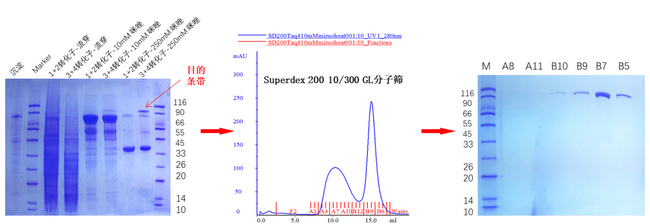
图7 某次实验中分子筛及SDS-PAGE结果
五、结语
近年来毕赤酵母表达系统已经成功高效表达了多个蛋白,不仅降低了成本又提高了表达量,例如a-淀粉酶,肿瘤坏死因子(TNF)等产量都能达到g/L的量级,是目前最为成功的外源蛋白表达系统之一。有理由相信毕赤酵母表达系统还将会用于更多外源蛋白的表达,在生物医药,美容护肤等领域留下浓墨重彩的一笔。
本期参考文献
1.酵母表达系统及其应用研究《生命的化学》2003年23卷1期, 吴丽娟、蒋建新;
2.毕赤酵母表达重组人血清白蛋白(rHSA)的条件优化试验研究。河南师范大学硕士学位论文,杨刚刚;
3.EasySelect Pichia Expression Kit,Rev.Date 18 June 2010,Manual part no.25-0172;
4.毕赤酵母表达外源基因研究进展《微生物学免疫学进展》2004年第32卷第1期,王勇、刘哲伟;
5.毕赤酵母多拷贝表达载体试剂盒,陈苗,商汉桥;
6.Atomic resolution structure of a lysine-specific endoproteinase from Lysobacter enzymogenes suggests a hydroxyl group bound to the oxyanion hole. Acta Cryst. (2014). D70, 1832–1843.
本文章版权归清华大学蛋白质研究技术中心蛋白质制备与鉴定平台所有





