近年来,由多重耐药性金黄色葡萄球菌引起的院内感染已对全人类的健康构成极大威胁。全球每年有近100万人死于无法用传统抗生素治疗的细菌感染,其中,耐甲氧西林金黄色葡萄球菌造成的死亡病例远超过由艾滋病和肺结核引起的死亡病例总和。金黄色葡萄球菌的耐药性往往与其能形成生物被膜密切相关。人们很早就在奶牛源金黄色葡萄球菌中发现一种被称作生物被膜相关蛋白(Biofilm associated proteins)的细胞表面蛋白Bap,Bap在介导葡萄球菌生物被膜的形成中发挥重要作用。Bap是一个多结构域蛋白,全长蛋白含有2276个氨基酸。最近的研究表明,Bap蛋白的N末端在低pH和低钙下易于聚集形成功能性淀粉样纤维,并且促进细菌聚集和生物被膜的形成。然而,Bap蛋白响应环境变化调控淀粉样纤维的形成以及介导生物被膜形成的机制并不清楚。
2021年5月28日,清华大学生命学院方显杨课题组在The EMBO Journal杂志发表了题为“葡萄球菌生物被膜相关蛋白开关调控功能性淀粉样纤维和生物被膜形成的结构机制(Structural mechanism for modulation of functional amyloid and biofilm formation by Staphylococcal Bap protein switch)”的研究论文。该项工作解析了Bap蛋白N末端BSP结构域的1.9 Å的高分辨率晶体结构,该结构呈现哑铃形折叠,连接BSP的N末端和C末端的中间模块(Middle module,MM)由两个串联的全新的钙离子结合基序组成。小角X射线散射(SAXS),核磁共振(NMR)和分子动力学模拟数据表明,中间模块响应钙离子浓度变化发生从有序到无序的构象转换。体外和体内的生化实验表明,BSP的N端在酸性(pH
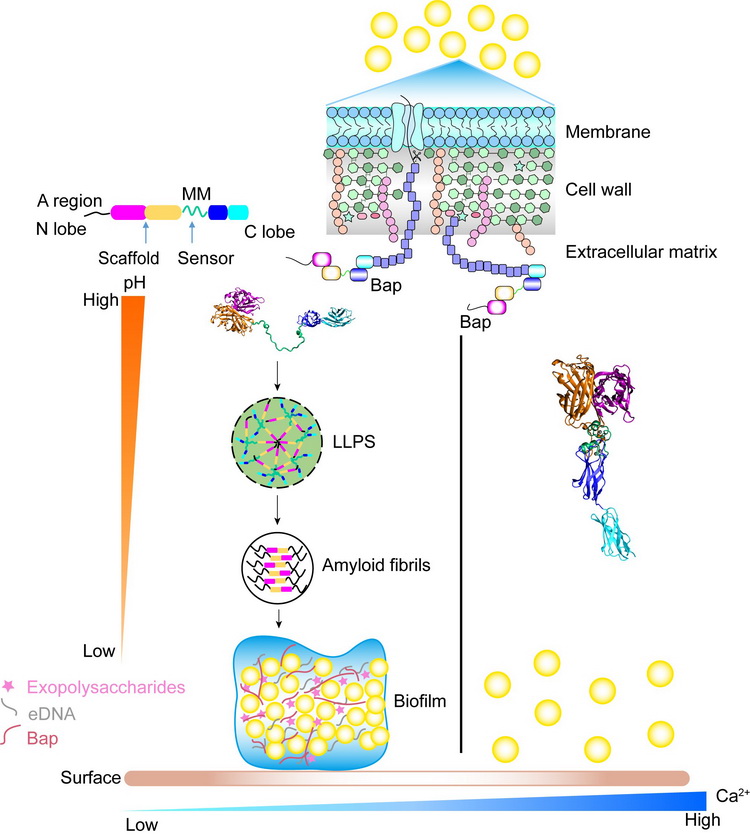
图1. Bap形成淀粉样纤维及介导金黄色葡萄球菌形成生物被膜的调控机制
该研究有以下重要发现:
1) BSP的N末端包含重复串联的结构模块,可作为支架蛋白介导液液相分离,并通过液固相变聚集为淀粉样纤维。这是迄今为止发现的第一个可经由相分离形成功能性淀粉样纤维的细菌细胞表面蛋白,表明相分离过程在细菌功能性淀粉样纤维的形成过程中发挥重要作用。
2) BSP的中间模块作为一种新颖的钙离子结合基序,其结构与近年来在真核和原核生物中发现的多种钙离子结合基序完全不同。尽管曾被预测为EF-hand,晶体结构表明,该基序形成了Loop-Helix-Loop的结构且结合两个钙离子,与传统的EF-hand形成Helix-Loop-Helix的结构仅结合一个钙离子完全不同,因而是一种全新的钙离子结合基序。中间模块通过感应钙离子和pH的变化而发生“无序↔有序”之间的构象转变,赋予细菌响应外界环境信号并在特殊条件下生存的能力。
3) 在低pH和低钙离子浓度条件下,BSP的各结构模块协同性的调控淀粉样纤维的形成进而介导金黄色葡萄球菌生物被膜的形成。
清华大学生命学院方显杨助理教授为文章的通讯作者, 2016级博士研究生马俊锋是文章的第一作者,研究助理程翔,2017级博士研究生徐钟河,已毕业博士生张一堪对该课题做出了重要贡献。西班牙纳瓦拉公立大学Iñigo Lasa教授,美国阿贡国家实验室左孝兵博士为该项研究的重要合作者。清华大学高精尖创新中心王佳伟教授和范仕龙博士对晶体数据收集与处理进行了指导和帮助。清华大学生命学院梁鑫副教授和医学院张敬仁教授在实验材料方面给予了大力帮助。清华大学蛋白质研究技术中心、膜生物学国家重点实验室和上海同步辐射光源为本研究提供了设备和技术支持。本研究得到了国家自然科学基金、科技部重点研发计划、北京结构生物学高精尖创新中心、清华-北大生命科学联合中心的经费支持。
原文链接:https://www.embopress.org/doi/full/10.15252/embj.2020107500
转载连接:https://life.tsinghua.edu.cn/info/1131/2879.htmhttps://life.tsinghua.edu.cn/info/1131/2879.htmhttps://life.tsinghua.edu.cn/info/1131/2879.htmhttps://life.tsinghua.edu.cn/info/1131/2879.htm