线粒体作为真核细胞的重要细胞器在各种细胞活动中发挥不可忽视的作用,例如能量调节、细胞凋亡、自噬等。线粒体内有1500-2000种不同的蛋白协同完成各项功能,其中90%以上的蛋白都是在细胞质中合成的。因此,它们必须转运至线粒体内部才能发挥功能,这主要是通过TOM复合物完成的。定位于线粒体外膜的TOM复合物通过识别、传递、转运三个主要步骤将在细胞质中合成的蛋白转运至线粒体内部。在人体中,TOM复合物的缺陷和多种疾病相关,尤其是与帕金森综合症关系密切。完整的TOM复合物由7种不同的亚基构成,分别为β-桶结构用来形成通道的Tom40亚基;α-螺旋结构的受体蛋白Tom20、Tom22和Tom70;以及三个围绕Tom40的小亚基Tom5、Tom6和Tom7。虽然已有TOM复合物的结构发表,但由于受体亚基的不稳定性,发表的结构中都不包含Tom20、Tom70以及完整的Tom22胞质区,这极大限制了人们对于TOM复合物的转运机制的理解。
2022年6月22日,清华大学生命科学学院隋森芳教授课题组在《美国科学院院报》(Proc Natl Acad Sci U S A)杂志上发表了题为:“Tom20和Tom22的胞质结构域作为人源线粒体TOM复合体受体的结构基础(Structural basis of Tom20 and Tom22 cytosolic domains as the human TOM complex receptors)”的研究论文。通过冷冻电镜单颗粒分析技术解析了包含Tom22及Tom20胞质区的TOM复合物的高分辨率结构,并进一步结合生物化学方法推测了TOM复合物转运蛋白的机制。
隋森芳团队首先获得了人源线粒体TOM核心复合体(仅包含Tom40、Tom22、Tom5、Tom6、Tom7)的结构,分辨率高达2.53 Å,是目前该复合体的最高分辨率。该结构揭示了大量蛋白与蛋白以及磷脂与蛋白间的相互作用,这些相互作用对于维持TOM复合体的稳定性至关重要。他们进一步通过交联实验稳定TOM复合体,从而成功获得了包含受体蛋白Tom20及Tom22的胞质区的TOM复合体的结构,分辨率为3.74 Å。结构分析表明,Tom22的N端胞质结构域与Tom20的C端胞质结构域具有相似的三螺旋束结构。已有的研究表明Tom20的胞质结构域是被转运蛋白前序列(presequence)的主要结合位点,因此他们推测Tom22也可能通过其胞质结构域与前序列结合。进一步的生化实验结果证实了他们的猜想,并发现三螺旋束中的第一个螺旋对这种结合是关键的。这些结果为TOM复合体识别和跨线粒体膜转移蛋白的作用机制提供了深入的见解。
生命学院隋森芳教授和孙珊副研究员为本文共同通讯作者。生命学院2018级博士生苏家跃、已出站博士后刘德生为本文的共同第一作者。清华大学冷冻电镜平台工程师杨帆参与了电镜数据分析;生命学院2019级博士生李畅参与了生化样品的制备;北京生命科学研究所董梦秋研究员和博士生左美晴进行了交联质谱的工作。国家蛋白质科学研究(北京)设施清华基地冷冻电镜平台和计算平台为数据收集和处理提供了支持。膜生物学国家重点实验室、北京市结构生物学高精尖创新中心、北京生物结构前沿研究中心、科技部、国家自然科学基金等为本研究提供了经费支持。
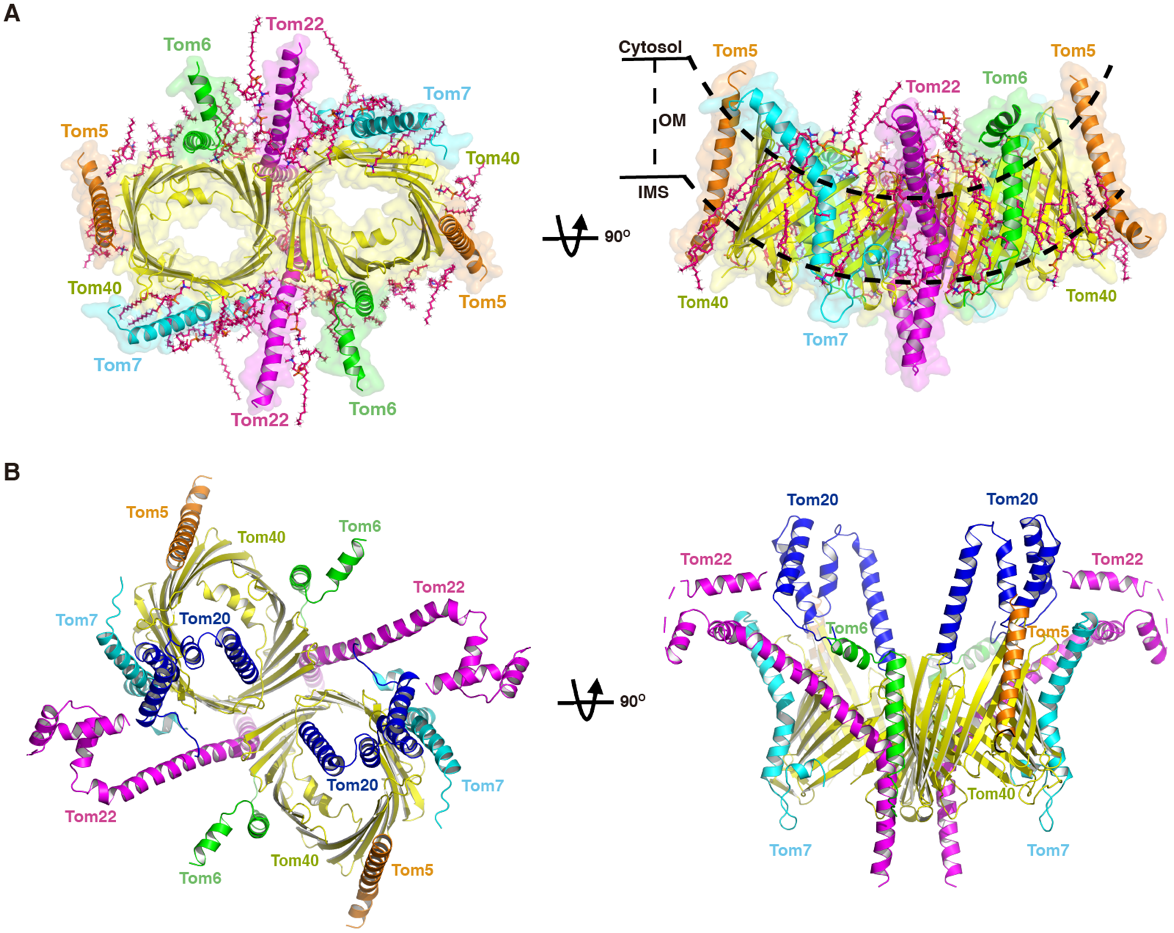
人源TOM复合物的结构。 A,TOM核心复合物的结构。B,包含Tom22及Tom20胞质区的TOM复合物的结构
论文链接:https://www.pnas.org/doi/10.1073/pnas.2200158119
转载链接:https://www.life.tsinghua.edu.cn/info/1131/3920.htm