生物大分子的三维结构可以直观地揭示其生物学功能、细胞内进程以及探索其在疾病中发挥作用的方式。冷冻电镜(cryo-electron microscopy, cryo-EM)单颗粒分析技术通过对生物大分子的直接成像进行高分辨率结构测定,已成为结构生物学的重要研究手段。冷冻电镜单颗粒技术需要对生物大分子溶液的冷冻样品采集大量电子显微数据,以进行三维结构解析,因此高质量的冷冻样品制备在冷冻电镜技术中起着至关重要的作用。良好的制样方法需要能够简便地,可控地制备出接近理想状态的生物大分子冷冻样品。
诺贝尔奖获得者Jacques Dubochet等人于1984年发明了冷冻样品制备的滤纸夹置法(Pipet-blot-plunge),至今仍然是冷冻电镜样品制备的主要手段。在这种传统的制样方法中,研究人员难以精确控制样品冰层厚度和大分子颗粒分布,导致冷冻样品的均一性和可重复性较差。越来越多的证据表明,在样品被冷冻之前的瞬间,生物大分子会吸附在超薄的液体层的气液界面(Air-water interface, AWI)上,导致生物大分子的颗粒结构损伤、变性或产生优势取向,减低了高分辨率冷冻电镜结构分析的效率和成功性。如何获取可重复的高质量的生物大分子冷冻样品仍然是冷冻电镜技术应用中的一个卡脖子问题。
2024年4月25日,清华大学生命科学学院王宏伟教授课题组和清华大学精密仪器系欧阳证、周晓煜课题组在《自然-方法学》(Nature Methods) 在线发表了题为“电喷雾辅助的冷冻电镜样品制备方法用以减轻界面吸附效应”(Electrospray-assisted cryo-EM sample preparation to mitigate interfacial effects)的研究论文。研究采用非变性质谱(Native mass spectrometry, native MS)中广泛使用的电喷雾电离(Electrospray ionization, ESI)技术,设计并搭建了一种新型冷冻样品制备装置,ESI-cryoPrep(图1),成功实现了无需滤纸夹吸的冷冻样品制备,并获得了多种生物大分子近原子分辨率的三维结构。该研究表明ESI-cryoPrep可以有效地将生物大分子颗粒完整嵌入无定形态薄层冰中,避免其吸附在空气-水、固体-水界面上,并对该装置制备生物大分子冷冻样品过程中的界面模型进行了机理阐释。ESI-cryoPrep以“软”电离技术ESI为基础,通过向蛋白溶液施加高电压形成大量带电的蛋白液滴,可以有效地减少蛋白的变性与碎裂。在电场的驱动下,带电液滴飞向电镜载网的过程中伴随着去溶剂化的进行;液滴表面的电荷密度激增至瑞利极限导致库仑裂变形成带电的次级液滴;这一过程循环往复直至液滴最终沉积在电镜载网上;收集到带电液滴的电镜载网被插入液氮冷却的液态乙烷中即可实现对液滴的快速冷冻。该过程完全省却了滤纸的夹吸,避免了滤纸材料对液体和生物大分子的影响。因为液滴表面的小分子离子形成了双电层效应,生物大分子与液体的界面被隔绝开,从而避免了生物大分子吸附到气液或固液界面上,更好地保持了生物大分子的天然结构。该研究首次对ESI液滴中的生物大分子的天然结构(Native structures)进行了直接测定,指导获得ESI的“软着陆”电离参数进行冷冻制样与非变性质谱分析。该工作是冷冻电镜与质谱技术的交叉融合,共同致力于解答生物大分子结构解析与分析的科学问题。
研究团队在搭建的设备上,经过多次摸索确定了制备高质量冷冻样品的相关参数。这些参数既能满足保存高比例完整结构生物大分子颗粒的需求,又能促进带电液滴在附着电镜载网表面的扩展和浸润。研究团队运用优化的ESI-cryoPrep装置制备了五种生物大分子的高质量冷冻样品,获得了与目标生物大分子尺寸相对应的理想冰层厚度,并实现了全部测试样品70S ribosome、20S proteasome、apo-ferritin、ACE2和streptavidin的高分辨率三维结构解析,分辨率分别为2.7 Å、2.0 Å、2.1 Å、3.3 Å和1.9 Å。
研究团队对冷冻电镜数据进行了深入的挖掘与分析,发现与预期假设一致的结果:ESI-cryoPrep可以有效地将生物大分子颗粒完整嵌入无定形态冰的薄层中间,抑制目标生物大分子在空气-水或石墨烯-水界面的吸附(图2),从而避免蛋白质颗粒的结构损伤或者优势取向问题。研究工作提出了电荷残留模型,阐明了电喷雾电离产生的液滴表面的电荷不均匀分布保护蛋白质颗粒免于界面吸附的作用和机制。这种学科交叉的研究成果不仅将为冷冻电镜样品制备提供应用价值,还将对冷冻电镜技术和非变性质谱领域的交叉和发展产生积极影响,为更多创新应用开辟新的可能性。自主研发的高质量冷冻电镜样品制备装置,一方面可以缩短结构解析的漫长探索过程,更高效地获得高分辨三维结构,分析其作用机理;另一方面也提升了原创研发具有自主知识产权和高精尖技术的能力,减少对国外相关仪器和设备的依赖。
清华大学生命科学学院2017级博士生杨梓和精密仪器系2018级博士生范菁津(已毕业)为该论文共同第一作者,清华大学生命科学学院王宏伟教授、清华大学精密仪器系欧阳证教授和周晓煜副教授为共同通讯作者,清华大学生命科学学院王家副研究员和清华大学生命科学学院范潇博士等为课题的启动和推进做出重要贡献。研究工作得到国家自然科学基金、腾讯基金会等项目资助,并得到清华大学冷冻电镜中心和计算中心的技术支持。
原文链接:https://www.nature.com/articles/s41592-024-02247-0
转载链接:https://life.tsinghua.edu.cn/info/1131/5740.htm
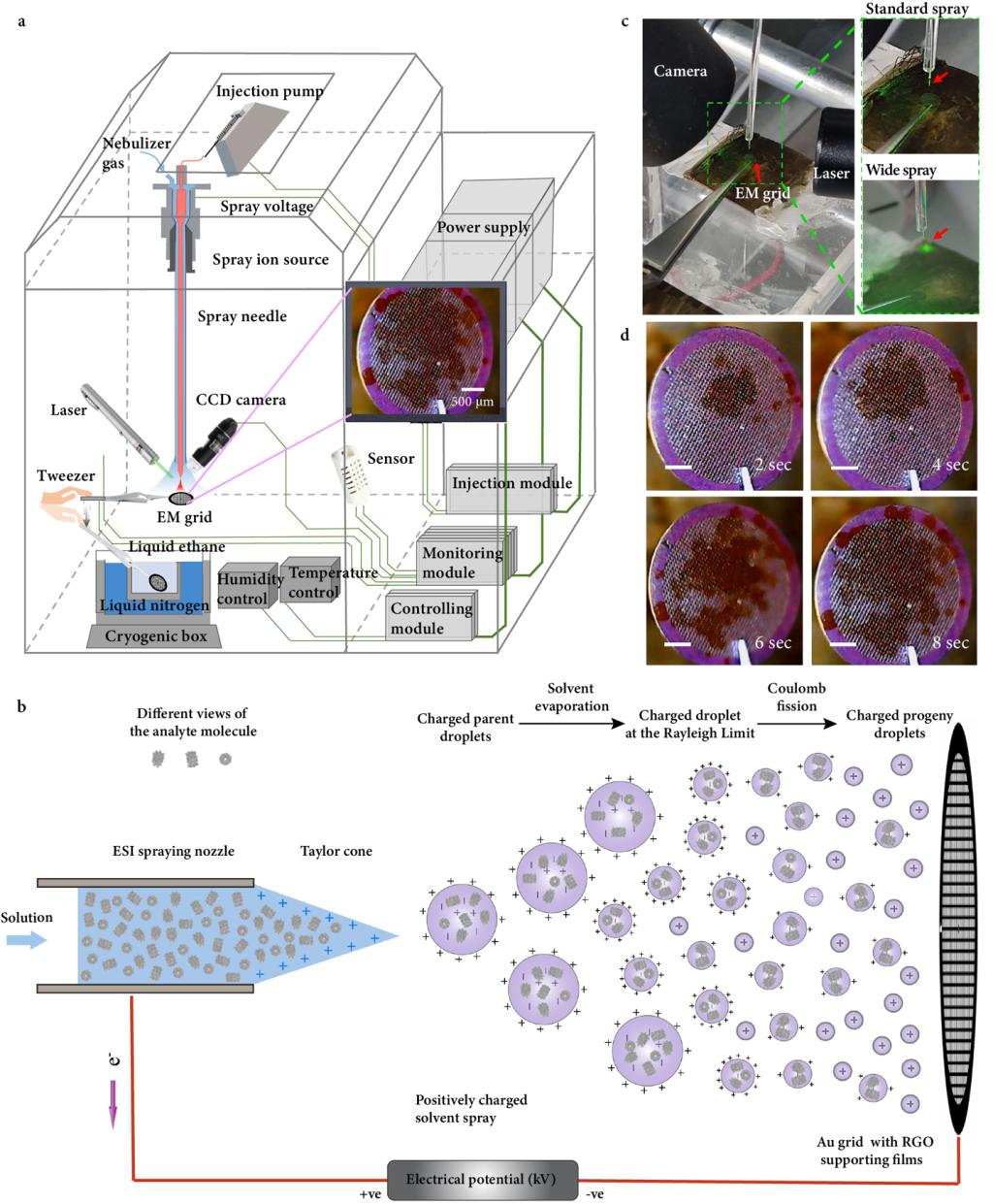
图 1:ESI-cryoPrep 方法设计和仪器装置示意图。
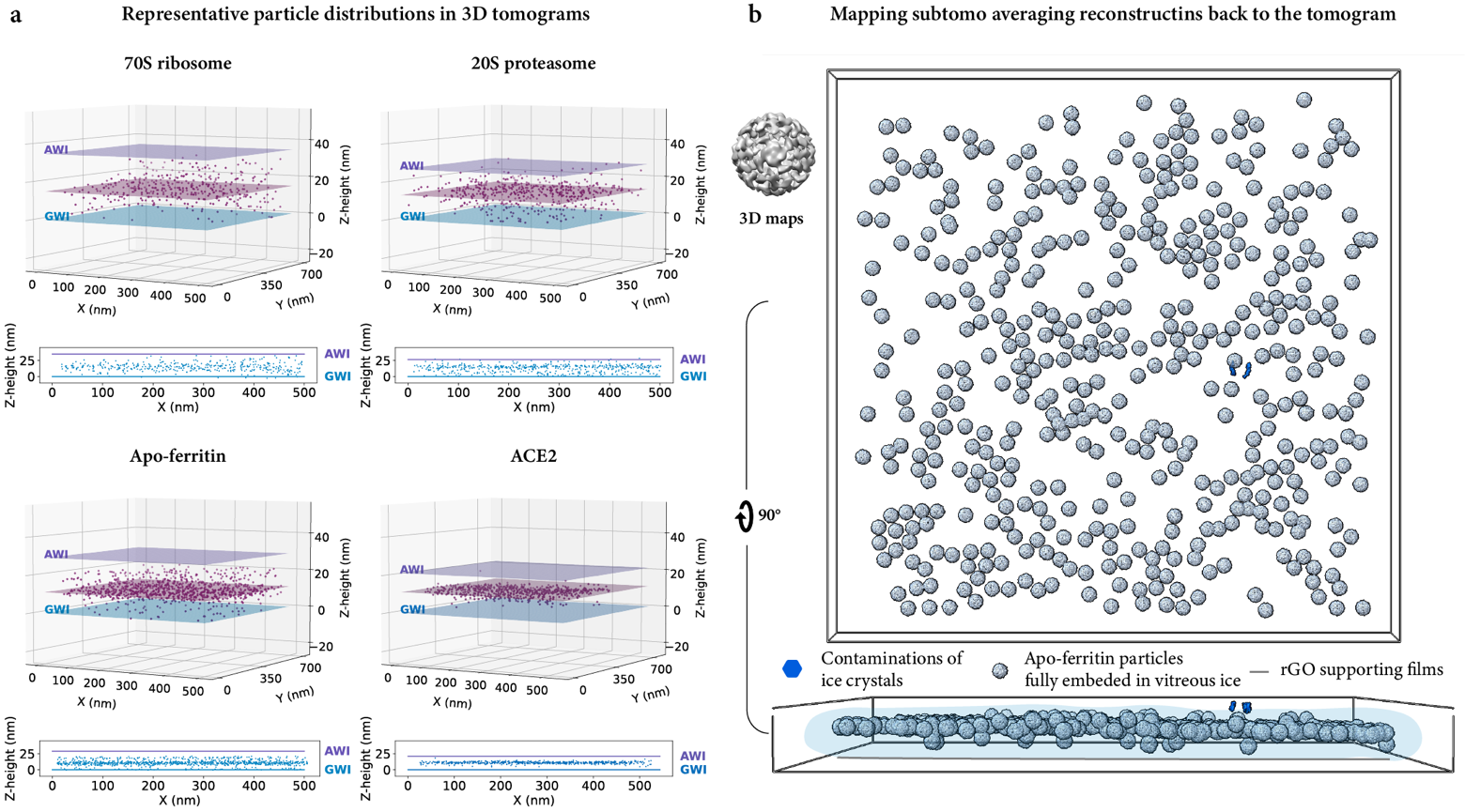
图 2:ESI-cryoPrep 方法制备的冷冻样品中蛋白质颗粒在断层成像中的代表性空间分布。