多角度激光散射(MALS)是一种测定生物分子绝对分子质量的技术。溶液中的大分子受一束激光照射时,分子中的电荷受光的电场影响而震动,产生散射光。散射光强与电场强度的二次方(E2)成正比,游离的分子之间产生非相干光,散射光强正比于(E12+E22),而结合在一起的分子复合物产生相干光,散射光强正比于(E1+E2)2。基于此原理,游离的A/B分子和结合在一起的AB复合物会产生的不一样的散射信号。实验室检测过程中,固定角度的散射光强正比于物质的分子量,浓度和比折光指数增量(dn/dc)的二次方(图1)。
图1:多角度静态光散射技术示意图及原理
实验室一般通过MALS联用AKTA和SEC分离柱,样品经过SEC分离后依次通过UV检测器,MALS,dRI,同步采集三个检测器的数据。对于已知比折光指数增量(dn/dc)或紫外消光系数的样品,可以选择UV或dRI中的一个数据作为浓度来源,计算分子量,对于未知样品(糖蛋白,蛋白核酸复合物等),则需要联用UV和dRI,根据复合物中两种物质分别的紫外消光系数和dn/dc来首先计算复合物的整体参数。此方法除了应用在蛋白质、核酸,多糖等结合比的测定以外,还可以测定抗体偶联药物,AAV的空壳率等。
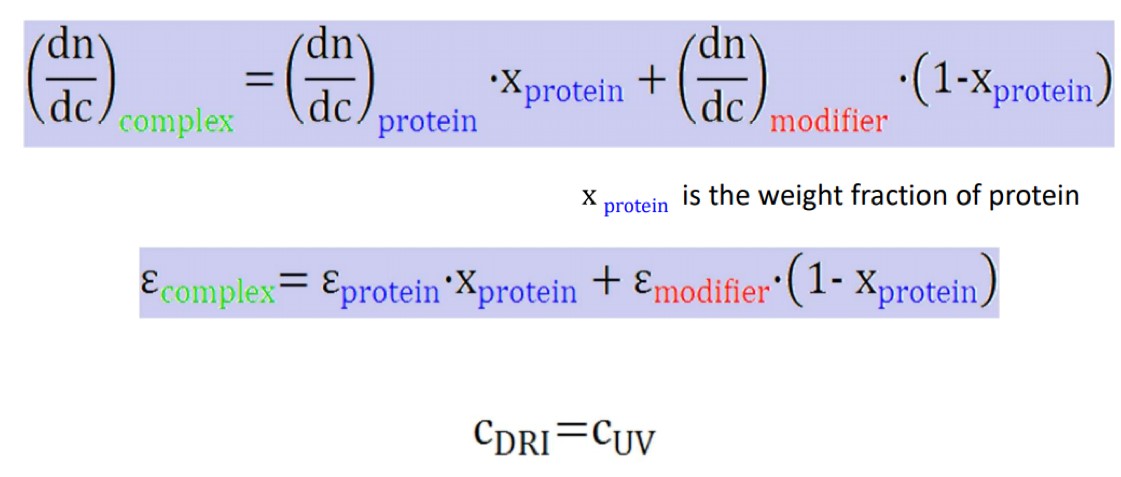
图2:SEC-MALS中复合物整体消光系数和dn/dc计算
SEC-MALS实验设计:本实验室常规实验中,样品浓度0.5-2mg/ml,体积100ul,根据分子量大小选择合适的SEC分离柱。测定复合物结合比例的实验推荐首先分别测定单体的分子量和聚合状态。
SEC-MALS数据解读:以标准品BSA的结果(图3)为例,X轴为洗脱体积/时间,左Y为该时间点流经检测池的样品分子量,右Y分别为光散射(LS)或紫外吸收(UV)或dRI信号。UV或dRI信号指示蛋白质等生物分子的实时质量浓度,LS信号强度则与实时样品的分子量和质量浓度相关。图3为标准品BSA的测试,由图可知,BSA有三种聚合状态,分别为单体,二聚体和三聚体。
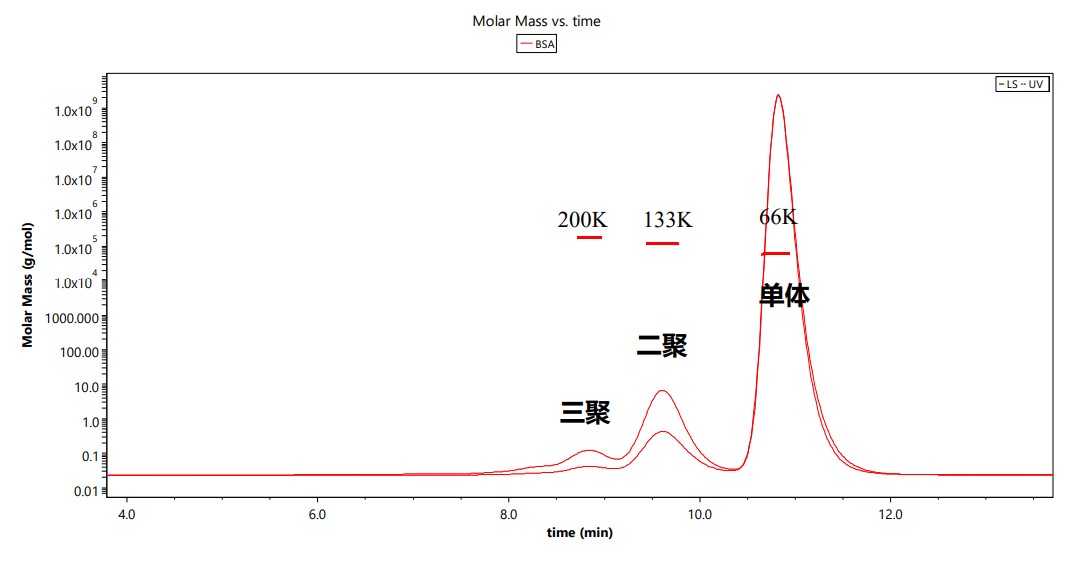
图3:标准品BSA的SEC-MALS分析
案例分享
一:蛋白-蛋白复合物
泛素化修饰是蛋白质最普遍的翻译后修饰之一,几乎参与一切生命活动的调控。嗜肺军团菌的效应蛋白MavC能催化泛素分子与底物UBE2N通过异肽键交联,从而对UBE2N的K92和K94位点进行泛素化修饰,是一种非经典的泛素化修饰,该过程可被另一种效应蛋白Lpg2149抑制。北京化工大学冯越教授实验室解析了MavC/UBE2N/Ub(三元)、MavC/UBE2N-Ub(产物,二元)以及MavC/Lpg2149三种蛋白质复合物的结构,揭示了这种由谷氨酰胺转胺酶介导的新型泛素化及其抑制的分子机制1。文中使用SEC-MALS分别测定了MavC和Lpg2159单体及复合物的分子量,结果显示单体MavC和Lpg2149的分子量分别为43.1和11.9,复合物结合比例为1:1,与结构解析结果一致。
图4:MavC-Lpg2149复合物的分子量分析
二:蛋白质-核酸复合物
Argonaute蛋白在原核,古细菌,真核生物中普遍存在,是RNA干扰机制中的关键元素。嗜热古菌Archaeoglobus fulgidus的Ago蛋白包含N端MID和C端PIWI两个结构域,形成稳定的同源二聚体。Zaremba等利用SEC-MALS发现,溶液中AfAgo以同源二聚体为主,与DNA以2:2比例结合,而删除了296-303位氨基酸的突变体则以单体为主,与DNA的复合物主要以1:1结合(图5),与SAXS的结果一致2。
图5:AfAgo-DNA复合物的SEC-MALS分析
三:膜蛋白-去垢剂
膜蛋白在利用去垢剂从细胞膜上剥离之后,会与去垢剂结合在一起,准确测定复合物中蛋白分子量的技术有MALS和分析超速离心AUC等。SEC-MALS的实验中,首先测定了去垢剂胶束的分子量,使用低浓度DDM buffer (0.03%)平衡系统,然后以高浓度DDM buffer (0.5%)为样品进样,得到DDM胶束的分子量约为66kDa。之后同样以低浓度DDM buffer平衡系统,进浓缩后的GltT-DDM样品。复合物在胶束之前出峰,通过代入二者分别的紫外消光系数和dn/dc,得到主峰中蛋白为154kDa,去垢剂为125kDa,进一步确定GltT为同源三聚体(图6)。文中同时测定了LacS蛋白,说明了SEC-MALS鉴定膜蛋白分子量的准确性3。
图6:DDM胶束及GltT/DDM的分子量分析
四:糖蛋白
HIV1的envelope蛋白是一个高度糖基化的三聚体,共有84个N-糖基化位点。为了测定可溶HIV1-E蛋白疫苗的分子量,Paula Lei等分别利用了SEC-MALS和LC-MS技术。结果显示(图7),E蛋白总分子量为339kDa,其中蛋白占比63%,糖基化修饰占比37%,SEC-MALS和LC-MS检测结果一致,说明SEC-MALS可以准确地测定糖基化蛋白的准确分子量和糖基化修饰比例4。
图7:HIV1-E蛋白三聚体的糖基化分析
参考文献:
1. Mu, Y., Wang, Y., Huang, Y. et al. Structural insights into the mechanism and inhibition of transglutaminase-induced ubiquitination by the Legionella effector MavC. Nature Communications 11, 1774 (2020).
2. Golovinas, E., Rutkauskas, D., Manakova, E. et al. Prokaryotic Argonaute from Archaeoglobus fulgidus interacts with DNA as a homodimer. Scientific Reports 11, 4518 (2021).
3. D. J. Slotboom et al., "Static light scattering to characterize membrane proteins in detergent solution," Methods 46(2), 73-82 (2008).
4. Bender M F, Li Y, Ivleva V B, et al. Protein and glycan molecular weight determination of highly glycosylated HIV-1 envelope trimers by HPSEC-MALS. Vaccine, 2021(7523).