作者:陈宇凌
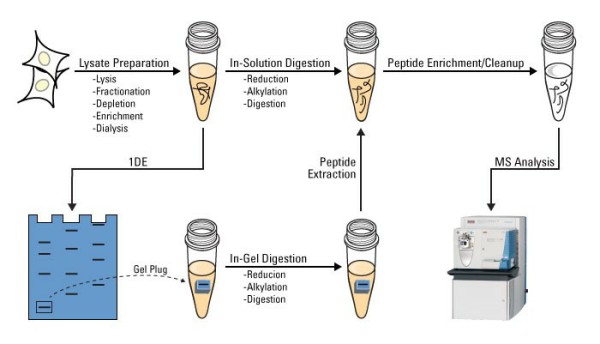
图1 溶液内酶解和胶内酶解步骤
基于质谱技术的蛋白质化学平台为用户提供包括常规蛋白质鉴定、蛋白修饰鉴定、蛋白NC端分析、定量蛋白质组学分析、修饰蛋白质组学分析、完整蛋白分子量精确测量以及H/D交换质谱分析等。除后两者外,前几项分析都需要对蛋白进行酶解前处理,将蛋白消化成肽段,以便于质谱测序分析。酶解前一般需要对溶液内或胶内的蛋白进行二硫键还原,并对蛋白中的巯基进行烷基化修饰(图1)。经典的流程中还原和烷基化分两步进行,耗时约1.5小时,是不是可以将这两步操作合并,实现一步还原和烷基化的反应呢?答案当然是肯定的!下面我们就来看看,二硫键还原和烷基化里藏着的小窍门!
酶解前处理一般需要还原蛋白中的二硫键,破坏蛋白结构来加强酶解的效率。常用的还原剂一有二硫苏糖醇(DTT)或三(2-羧乙基)膦(TCEP)。为了阻止还原后的自由巯基再次形成二硫键,我们经常使用烷基化试剂将巯基封闭,常用的烷基化试剂有碘乙酰胺(IAM,iodoacetamide)、氯乙酰氨(ClAM,chloroacetamide)、碘乙酸和N-乙基马来酰亚胺等。
1.二硫键还原剂
DTT是苏糖醇的C-1及C-4位羟基置换成巯基的化合物,如图2所示,常常被用于蛋白质中二硫键的还原,可阻止蛋白质中的半胱氨酸之间形成蛋白质分子内或分子间二硫键。DTT有两个巯基基团,还原二硫键的作用能维持3-7天,其还原状态下为线性分子,被氧化后变成包含二硫键的六元环状结构。由于质子化的硫的亲核性较低,随着pH值的降低,DTT的还原力也随之降低。
TCEP是一种无色、无味、易溶于水的弱还原性物质,在空气和水溶液中具有较高稳定性。TCEP属于三价膦系衍生物,其还原二硫键的原理是其中心原子P所带的孤电子对能与氧原子形成配位共价结合而具有还原性。TCEP具有很多DTT所不能比拟的好处,其对还原二硫键选择性极强,除半胱氨酸外,几乎没有与其它氨基酸的副反应,最重要的是,能在更宽的pH范围内(可以低至pH3)使用,还原能力强于DTT,作用可维持2-3周。
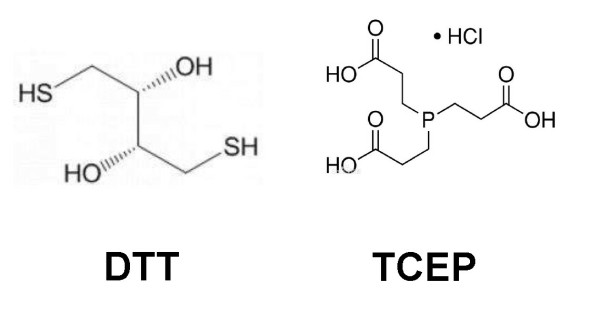
图2 DTT和TCEP的分子式
从图2的结构中,我们很容易看出,DTT上的巯基也会和烷基化试剂反应,因此为了防止DTT在还原二硫键之前就被烷基化试剂中和,DTT和烷基化试剂不能同时加入到蛋白溶液或者蛋白胶中;但是,TCEP由于还原原理不同于DTT,可同时和烷基化试剂一起加入,并且作用更强更稳定,是一种高效地还原二硫键的DTT替代物。
2.巯基烷基化
巯基具有很强的亲核性,被还原后的巯基一般需要进行烷基化封闭,避免其再次形成二硫键。目前我们最常用的烷基化试剂是碘乙酰胺,但实验和已有文献均表明[1],碘乙酰胺不但会对半胱氨酸的巯基进行修饰,还能和赖氨酸的残基反应,在赖氨酸上添加分子量为114.0429 Da的修饰,和泛素化酶切后留下的双甘氨酸修饰分子量近似,如图3所示。因此,在鉴定泛素化修饰时,应该避免使用碘乙酰胺对蛋白进行烷基化修饰,以免鉴定出假阳性的泛素化修饰位点。
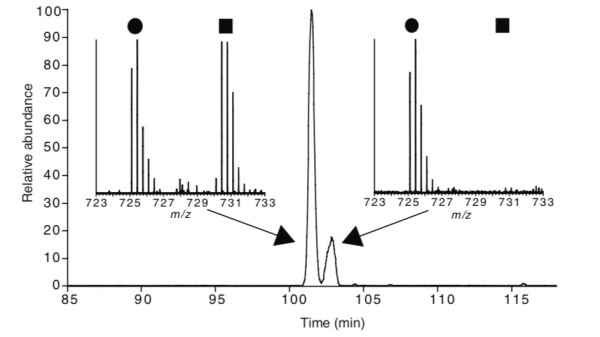
图3 碘乙酰胺可以在赖氨酸上添加分子量和双甘氨酸标签类似的修饰[1]
将组蛋白使用SILAC标记,轻标组蛋白使用碘乙酰胺修饰,重标组蛋白不使用碘乙酰胺修饰,混合后酶解,可看到肽段VTIAQGGVLPNIQAVLLPK*K (*, 泛素化修饰位点)在HPLC上有两个分子量近似峰,第一个峰在重标和轻标样品中都存在,即泛素化修饰肽段;第二个峰只存在于轻标样品中,即赖氨酸被碘乙酰胺修饰的肽段。
氯乙酰氨,和碘乙酰胺类似,是一种针对半胱氨酸特异性更强的烷基化试剂[2]。已有报道证明,氯乙酰胺能够有效烷基化巯基,并且不产生双甘氨酸类似修饰,如图4所示。
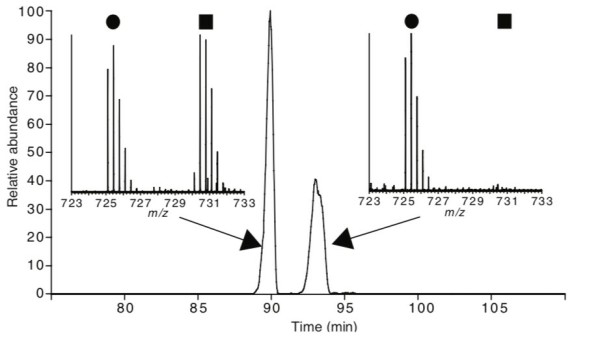
图4 氯乙酰胺不与赖氨酸残基反应
将组蛋白使用SILAC标记,轻标组蛋白使用碘乙酰胺修饰,重标组蛋白使用氯乙酰胺修饰,混合后酶解,可看到肽段VTIAQGGVLPNIQAVLLPK*K (*, 泛素化修饰位点)在HPLC上有两个分子量近似峰,第一个峰在重标和轻标样品中都存在,即泛素化修饰肽段;第二个峰只存在于轻标样品中,即赖氨酸被碘乙酰胺修饰的肽段。
说了这么多,其实操作就很简单了。在进行胶内酶解的二硫键还原和烷基化步骤时,向干燥的蛋白胶粒中加入含有10 mM TCEP和25 mM氯乙酰胺的50 mM碳酸氢铵溶液,避光常温反应30min,蛋白的还原烷基化即可大功告成!
参考文献:
1.Michael Nielsen, Michiel Vermeulen, Tiziana Bonaldi, Jurgen Cox, Luis Moroder and Matthias Mann. Iodoacetamide-induced artifact mimics ubiquitination in mass spectrometry. Nature Methods, 2008, 5: 459-460.
2.Knut H. DAHL and John S. McKINLEY-McKEE. The imidazole-promoted inactivation of horse liver alcohol dehydrogenase. Bioorg. Chem., 1981, 10: 329-341.
本文章版权归清华大学蛋白质研究技术中心蛋白质化学与组学平台所有