作者:王乐乐
Mosquito在蛋白质晶体学研究中主要用于高通量蛋白结晶条件的微量加样和筛选,可以实现坐滴、悬滴、接种实验(seeding)、微量添加剂实验、LCP实验等等多种方法的应用。文章主要介绍了坐滴法和悬滴法的原理,以及结晶筛选前的准备工作,并详细介绍了Mosquito如何采用坐滴法和悬滴法进行蛋白结晶筛选的一些具体应用,其他方法的应用将在以后文章中单独详细介绍。
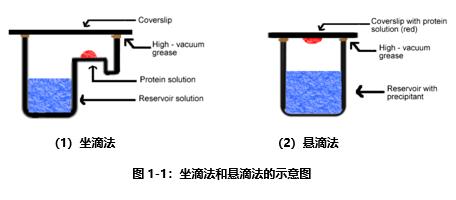
目前最常采用的可溶性蛋白结晶筛选方法是蒸气扩散法 (Vapor-Diffusion),包括坐滴法(The sitting drop method)和悬滴法(The hanging drop method)。如下图1-1(1)所示,坐滴法的主要步骤为在储液槽中加入池液,即不同配方的蛋白质溶剂,向坐滴板的Drop中加入高浓度纯化蛋白溶液(5-40mg/ml),在蛋白上点入池液,用透明度较高的封口膜封口,将坐滴板放置于培养箱或者培养室中培养,应注意避免震动及温度的剧烈变化;如下图1-1(2)所示,悬滴法的主要步骤为向悬滴板中加入池液,向悬滴法封膜的盖板中点入高浓度纯化蛋白,向盖板中的蛋白上继续点入池液,用点过蛋白的封膜封住悬滴板,将悬滴板置于培养箱或者培养室中培养,应注意避免震动及温度的剧烈变化。
在进行实验之前,首先要准备好蛋白质溶液,要求样品纯度达到90%以上,样品浓度大概在5-40mg/mL。平台目前有十几种可溶性蛋白的晶体筛选kit,5种膜蛋白的筛选Kit以及两种核酸的筛选Kit,约2000多个条件,这些Kit均通过平台的Tecan公司的配液工作站Freedom提前分装到96孔晶体板中,方便用户使用,这部分工作将节约用户80%的工作量,大大提高了蛋白结晶筛选的效率。平台提供4度,16度以及20度的晶体恒温间和培养箱,以满足用户不同的结晶温度需求。此外通过全自动观察系统用户可以定期自动远程观察晶体板。用户只需要将纯化好的蛋白溶液准备好,其余工作都可以自动化的完成,真正实现全自动化流程。
此外,在进行实验之前,还有如下几个小建议供大家参考:
1.确定合适的蛋白浓度:
蛋白浓度直接影响着晶体筛选过程中晶体的生长,是需要提前确定的一个关键条件,所以在进行大量的条件筛选之前,建议先选择一到两种经典的筛选试剂盒进行试验,比如Crystal screen,PEG Rx等,选取2种以上的浓度,来确认最终合适的浓度。通过观察整板蛋白溶液和筛选液混合后的状态,如果整板超过80%以上都是蛋白沉淀状态,如下图1-2所示,说明蛋白浓度可能偏高,需要降低一些,反之亦然。确定合适的蛋白浓度之后,我们就可以开始进行大量的条件筛选了。
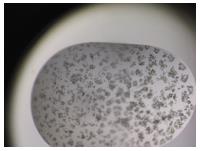
图1-2:蛋白的其中一种沉淀状态
2.蛋白溶液稳定性的测试:
除了蛋白浓度这一因素,蛋白质在溶液中的聚合状态和稳定性也会影响蛋白质的结晶,如果某种蛋白在经过大量条件筛选之后依然没有筛选出结晶条件,那么可以尝试通过平台的多参数蛋白质稳定性检测仪UNcle或者X射线小角散射仪来检测蛋白质在溶液中的状态,筛选出合适的buffer,金属离子添加剂或者抑制剂等,保证蛋白质在溶液中稳定性良好,然后再进行结晶筛选。
其中多参数蛋白质稳定性检测仪UNcle主要通过获得蛋白构象稳定性参数Tm和蛋白溶液中胶体稳定性参数Tagg来检测升温过程中蛋白质在溶液中的稳定性,还可以通过动态光散射DLS来进行溶液中蛋白质分子的粒径分析,检测蛋白质在溶液中的聚合状态;生物小角X射线散射仪主要通过收集溶液中蛋白的散射信号,分析数据解析出不同溶液中蛋白质分子的Rg(分子旋转半径),来判断蛋白质在溶液中的聚合状态。
3.使用加湿器的必要性:
在北方的干燥气候条件下,通常都需要用到加湿器,尤其是在点样体积小于200nL的时候,所以在进行方法编程时一般需要在前面加上Humidity Control这一项,或者在运行程序之前点击Humidity,加湿了一段时间之后再运行。以在Swissci 96孔坐滴板中进行一个蛋白样品加样的Protocol为例,添加Humidity Control后的Protocol如图1-3所示。Humidity Control这一步中,可以设置具体加湿的时间,以及选择high,medium,low三种湿度标准。其中high的湿度范围在65-75%,medium湿度范围在50-65%,low湿度范围在40-50%。通常选择medium就可以。
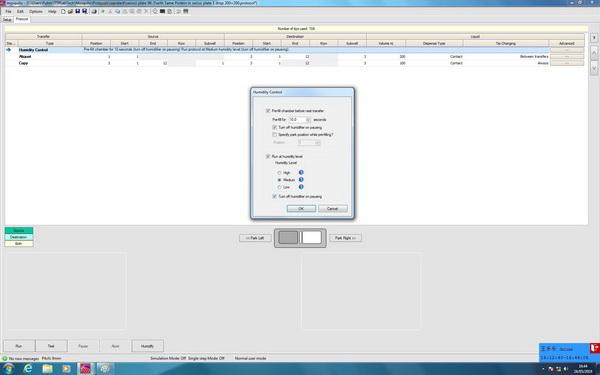
图1-3:添加Humidity Control项的Protocol
1.采用96孔坐滴板进行某一种蛋白结晶筛选的Protocol:
以Swissci的板型为例,如果每板点一个蛋白样品,那么可以按照如图2-1来编辑坐滴法的Protocol。
第一步移液方式选择Aliquot,从position 1中蛋白条适配器1号蛋白条中吸取样品,依次分装到position 3中96孔座滴板的1到12列的3号孔中。由于加样针一次最大可以吸取1.2微升,如果蛋白加样体积设置为100纳升,那么一次吸取之后可以分装一整板,如果超过100纳升,那么会吸取两次才能分装一整板。第一步换针的方式选择Between transfer,在这一步过程中将不换针,进行下一步移液的时候再换针,也可以选择Never。因为同一个蛋白,选择此换针方式可以节省针数。Between transfer和Never的区别主要在于当前一步和下一步是否相同的移液方式,如果相同,选Never时将不换针;选Between transfer时,不管是否相同都换针。而加样体积可以根据自己蛋白样品量的多少来确定,此例中选择200纳升体积。
第二步移液方式选择copy,从position 3中96孔板的1号孔中吸取一列池液加样到3号孔中,依次每列都如此加样。第二步换针的方式选择Always,每次吸取的池液都是不同的,必须每次加样都换针,因此总消耗针数为104根。
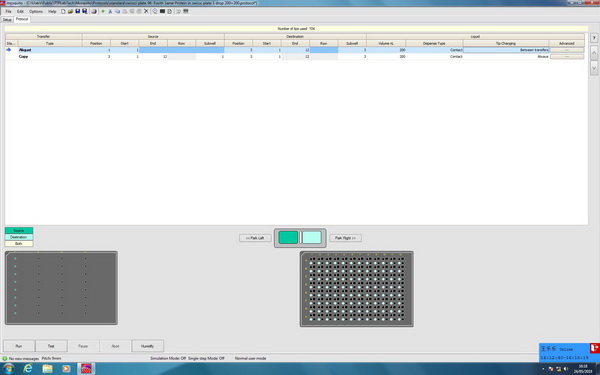
图2-1:采用Swissci 96-3板进行一种蛋白结晶筛选的Protocol
2. 采用96孔坐滴板进行一种蛋白3种不同浓度的结晶筛选的Protocol:
以Swissci的板型为例,如果每板点同一个蛋白3个不同浓度的样品,那么可以按照图2-4来编辑坐滴法的Protocol。第一步到第三步依次选择3种不同浓度的蛋白样品的Aliquot加样方式,先后顺序为蛋白浓度从低到高依次加样,分别从position 1中的蛋白条适配器第1,2,3列蛋白条依次加样到position 3中96孔座滴板的2,3,4号孔中 。因为同一种蛋白,换针的方式都选择Never。第四步到第六步选择copy的加样方式,分别从position 3中96孔座滴板的1号孔中吸取池液依次加样到2,3,4孔中。因为同一种蛋白,换针的方式选择Multi-dispence,那么每列针会同时吸够3个Drop所需的池液分3次加在3个Drop中,因此总消耗针数还是104根。
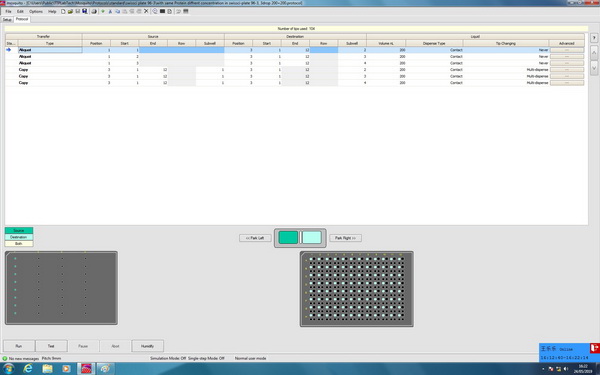
图2-2:采用Swissci 96-3板进行3种浓度的一种蛋白结晶筛选的Protocol
3. 采用96孔坐滴板进行3种蛋白结晶筛选的Protocol:
以Swissci的板型为例,如果每板点三个不同的蛋白样品,那么可以按照图2-5来编辑坐滴法的Protocol。由于都是不同的蛋白样品,所以可以参照1.1.1的protocol,依次运行3次,依次加样在96孔坐滴板的2,3,4孔中即可。这种情况,加蛋白和加池液的先后顺序不会影响消耗的针数,因此总消耗针数为312根。而每一个都是先加蛋白再加池液,可以避免液滴的蒸发影响到蛋白的浓度。
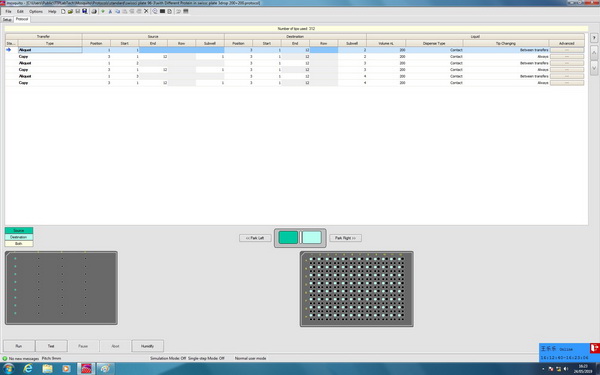
图2-3:采用Swissci 96-3板进行3种蛋白结晶筛选的Protocol
4. 其他各种情况的Protocol:
如果使用的坐滴板的板型有变化,那么可以在setup页面更改成相应的板型即可。同样的,用户可以根据自己的实验需求来编辑适合自己的Protocol,一般需要变化的内容包括加样点的数量,换针方式,加样的体积等等。平台根据这些需要调整的变化已经提前设置好各种可能用到的Protocol,满足大部分用户的使用需求,如果用户有特殊需求可以自定义自己的程序保存在自己的文件夹中,也可以找工作人员进行编辑。
平台已编辑好的Protocol在Mosquito的控制电脑中保存的路径为:C:UsersPublicTTPLabTechMosquitoProtocolstandard。
5.Mosquito采用坐滴法进行蛋白质结晶筛选的视频教程:
视频教程一为Mosquito的开机流程。
视频教程一:Mosquito开机操作
视频教程二为Mosquito采用坐滴法进行蛋白质晶体筛选的操作流程。
视频教程二:Mosquito坐滴法操作
第三部分
Mosquito采用悬滴法进行蛋白质结晶筛选的一些技术应用
1.采用96孔悬滴板进行一种蛋白结晶筛选的Protocol:
悬滴法与坐滴法的主要区别在于移液方式的选择上,以TTP的 96孔悬滴板为例,编辑的Protocol如图2-6所示。第一步选择Aliquot正向分装 ,也可以选择Reverse Aliquot反向分装,反向的要比正向总时间上稍慢几秒。从Position 2中5微升规格蛋白条吸取样品加到Position 3中96孔悬滴盖板的1到12列。第二步将坐滴法中的copy方式改成mirror,从Position 1中96孔板的第一列吸取池液加在Position 3中96孔悬滴盖板的最后一列,依次类推镜像加样,总消耗针数为104根。结束之后使用专用的适配器将加完样品的96孔悬滴盖板覆盖到TTP的96孔池液板上,完成悬滴实验。

图3-1:采用96孔悬滴板进行一种蛋白结晶筛选的Protocol
2.采用96孔悬滴板进行2种蛋白结晶筛选的Protocol:
由于这台设备的板位有限,所以悬滴法比较适用于点一个蛋白,如果想要点两个以上的蛋白,则需要在点完一个蛋白之后,手动更换Position 2中蛋白条及样品,再进行第2个蛋白的加样。若每个孔点的样品数量在2个以上,样品的体积也需要减少,否则液滴容易聚合到一起。
以在 TTP 96孔悬滴板中进行2种蛋白样品加样实验为例,编辑的Protocol如图2-7所示。首先Position 3中96孔悬滴盖板要选择有2个孔位的,编号分别为2号和3号。参照1.3.1中的程序,第一步和第二步是加一个蛋白样品和池液到Position 3中96孔悬滴盖板中的2号孔中。第三步添加一项Pause,这时程序会自动停止,弹出一个界面,所有板位会回到最初的位置,这时可以更换蛋白条和样品,换完之后点击界面中的resume,继续开始第三步和第四步,加第二个蛋白样品和池液到Position 3中96孔悬滴盖板中的3号孔中,完成所有加样,总消耗针数208根。结束之后使用专用的适配器将加完样品的96孔悬滴盖板覆盖到TTP的96孔池液板上,完成悬滴实验。
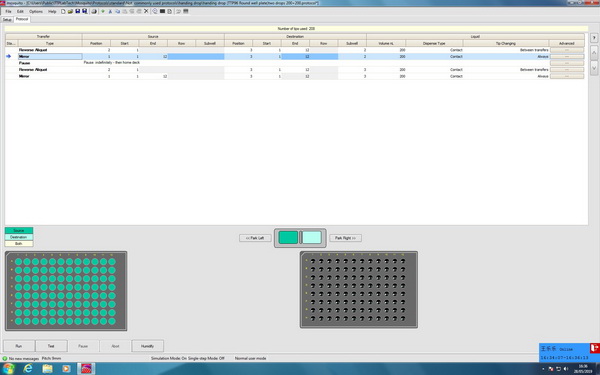
图3-2:采用96孔悬滴板进行2种蛋白结晶筛选的Protocol
3. 悬滴法的视频教程:
Mosquito设备采用悬滴法进行蛋白质结晶筛选的操作流程如下面的视频教程三所示。
视频教程三:Mosquito悬滴法操作





